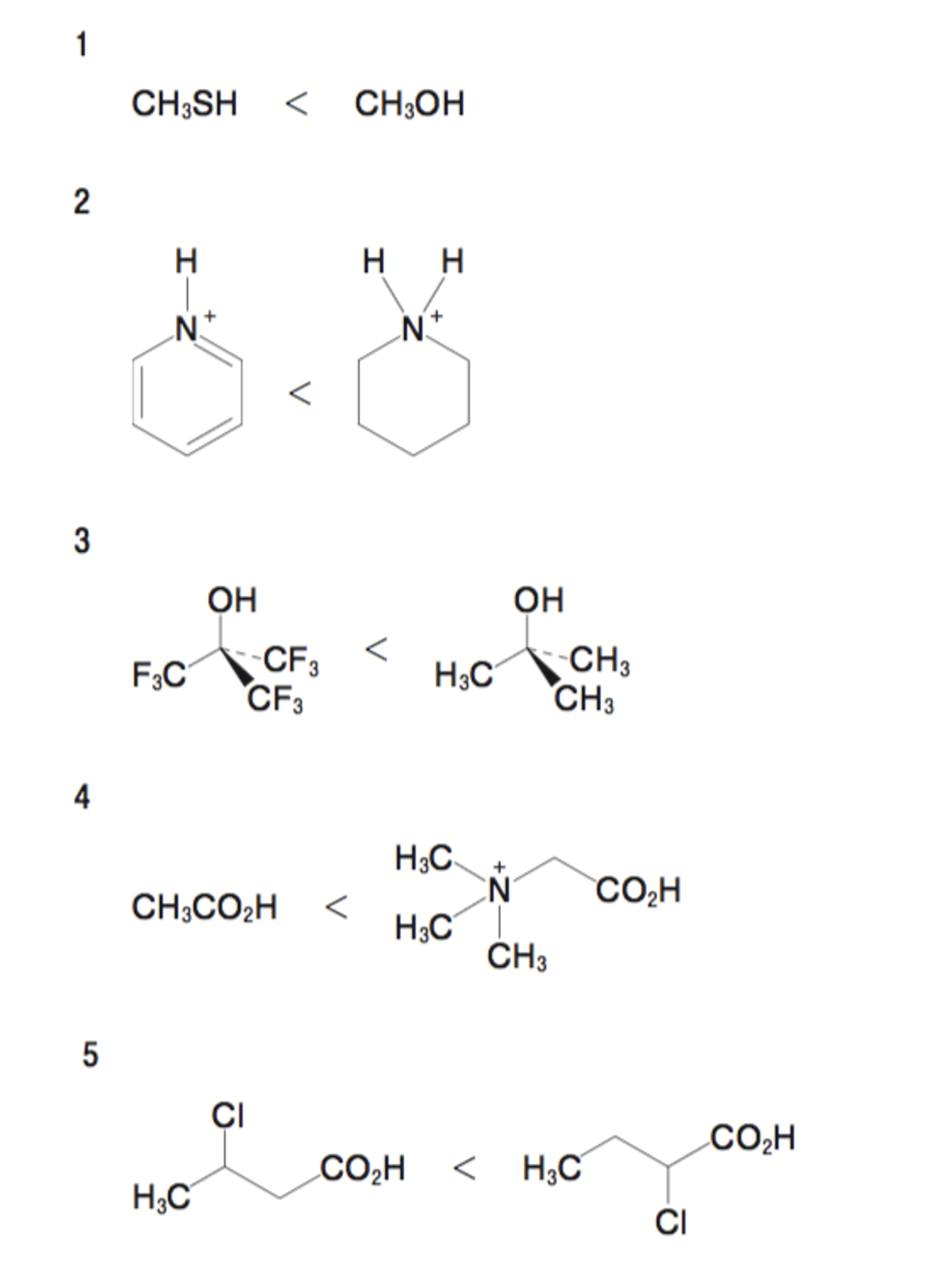
酸性の強さを比較したもののうち、正しいのはどれか。2つ選べ。ただし、第一解離のみを比較するものとする。
解答 解説 2 誤 3 誤 4 正 5 正解答・解説
4、5
1 誤
同族元素が水素に結合している場合、周期表の下の方がプロトン解離後の共役塩基が安定となる。そのため、CH3SHはCH3OHに比べ酸性度が大きい。
窒素原子は、非共有電子対が収容される混成軌道のs性が低いほど、塩基性が強いため、ピリジン(窒素の非共有電子対:sp2混成軌道)とピペリジン(窒素の非共有電子対:sp3混成軌道)では、ピペリジンの方が塩基性が強い。また、塩基性が弱い化合物ほど、その共役酸の酸性は強いため、ピリジニウムイオンはピペリジニウムイオンより酸性度が大きい。
電子求引基が結合するほど、酸性度が大きくなるため、トリフルオロメチル基(−CF3)が結合している方が酸性度が大きい
電子求引基が結合するほど、酸性度が大きくなるため、トリメチルアンモニウム基[-N+(CH3)3]が結合している方が酸性度が大きい
クロロは電子求引基として働くため、共役塩基の負電荷の安定性を高める。また、クロロ基が近いほど電子求引性が高まるため、2-クロロ酪酸は3-クロロ酪酸より酸性度が大きい。





コメント