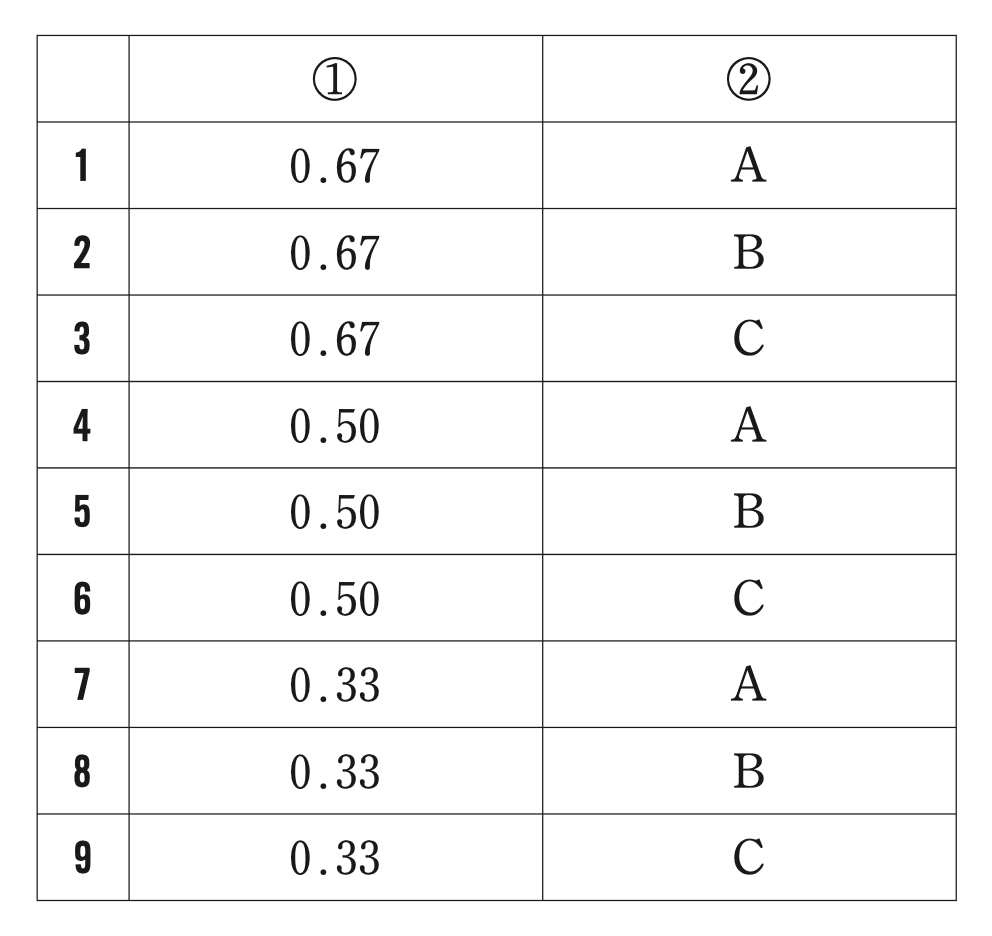
次の文章の「 」 に入る数値及び記号の正しい組み合わせはどれか。1つ選べ。
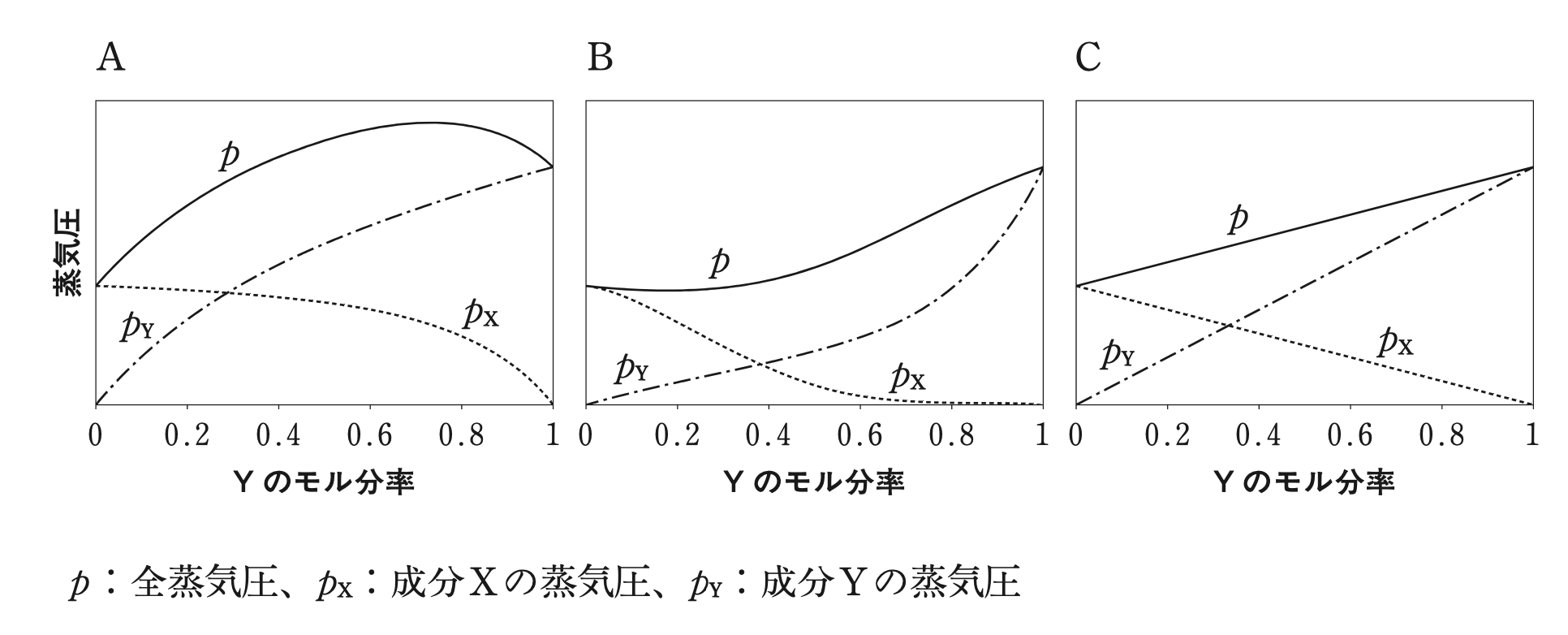
理想溶液がその気相と平衡にある場合、各成分の蒸気圧は溶液中のモル分率に比例する。成分XとYから成る液体を理想溶液とみなすとき、成分Xのモル分率0.5の溶液と平衡にある蒸気の成分Xのモル分率は 「 ① 」 となる。ただし、成分XとYの蒸気圧をそれぞれ500 hPa、1000 hPaとする。また、成分X、Yが理想溶液とみなせず、XとYの分子間相互作用が同種分子間の相互作用よりも弱い場合の圧力は 「 ② 」のようなグラフになる。
YAKUZEROの教材を紹介された方へ、Amazonギフト券進呈中
クリック
目次




コメント
コメント一覧 (1件)
[…] 第100回 問93 […]