次の酸化還元平衡式に関する記述について、誤っているのはどれか。1つ選べ。
Fe2++Ce4+⇄Fe3++Ce3+
なお、この反応の酸化還元電位(E )は、

で示され、Fe3++e- ⇄ Fe2+及びCe4++e- ⇄ Ce3+の標準酸化還元電位(E0)は、それぞれ0.78 V及び1.72 Vである。
- E0は、[酸化体]:[還元体]=1:1のときの電位である。
- Fe2+とCe4+の混合溶液では、反応は右に進む。
- Fe2+をCe4+で滴定すると、当量点における電位は1.25 Vである。
- Fe2+とCe4+の混合溶液では、Ce4+が還元剤として働き、Fe2+が酸化剤として働く。
解答・解説
解答
4
解説
1 正しい
[酸化体]:[還元体]=1:1のとき、log[酸化体]/[還元体]=0となり、E=E0となる。このことからE0は、[酸化体]:[還元体]=1:1のときの電位であると考えられる。
2 正しい
標準酸化還元電位が小さい反応ほど酸化反応を起こしやすいことから、Fe2+とCe4+の混合溶液では、Fe2+は酸化され、Ce4+は還元される(反応は右に進む)。
3 正しい
当量点における電位は、標準酸化還元電位の平均値で表すことができるため、(0.78 V+1.72 V)÷2=1.25 Vとなる。
4 誤っている
Fe2+とCe4+の混合溶液では、Ce4+が酸化剤として働き、Fe2+が還元剤として働く。

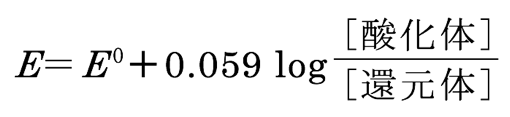


コメント