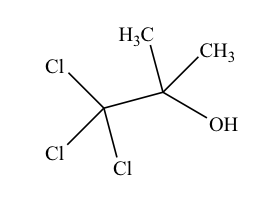
日本薬局方クロロブタノール(C4H7Cl3O:177.46)の定量法に関する記述のうち、正しいのはどれか。2つ選べ。
本品約0.1 gを精密に量り、200 mLの三角フラスコに入れ、エタノール(95)10 mLに溶かし、水酸化ナトリウム試液10 mLを加え、還流冷却器を付けて10分間煮沸する。冷後、希硝酸40 mL及び正確に0.1 mol/L硝酸銀液25 mLを加え、よく振り混ぜ、ニトロベンゼン3 mLを加え、沈殿が固まるまで激しく振り混ぜた後、過量の硝酸銀を0.1 mol/Lチオシアン酸アンモニウム液で滴定する(指示薬:硫酸アンモニウム鉄(Ⅲ)試液2 mL)。同様の方法で空試験を行う。
- 下線部の反応により、塩素(Cl2)が生成する。
- ニトロベンゼンを加えるのは、硝酸銀との反応により生成した沈殿とチオシアン酸アンモニウムとの反応を防ぐためである。
- 空試験の方が、本試験よりチオシアン酸アンモニウム液の滴加量は少ない。
- 0.1 mol/Lの硝酸銀液1 mLはクロロブタノールの5.915 mgに相当する。



コメント