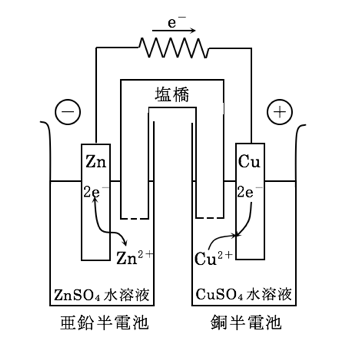
図は塩橋を用いたダニエル電池を示す。この電池の酸化還元平衡は次式で表せる。
また、Zn電極、Cu電極の標準電極電位(25℃)Eoはそれぞれ-0.763 V、0.337Vである。次の記述について、正しいのはどれか。1つ選べ。
- 図の左側の電極では還元反応が、右側の電極では酸化反応が起こり、全電池反応は(1)式となる。
- 電池の起電力は、左側の電極を基準とし、還元電位とも呼ばれる。
- 起電力は左側の半電池を基準とするので、ダニエル電池の標準起電力Eoは1.10 Vである。
- 塩橋を用いているので、電極電位以外に液間電位差を考慮する必要がある。

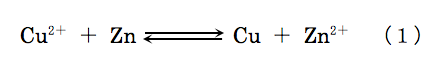

コメント