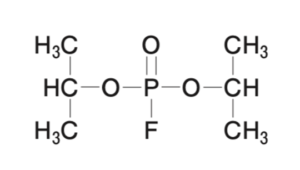
日本薬局方塩化カルシウム水和物(CaCl2・2H2O:147.01)の定量法に関する記述のうち、正しいのはどれか。2つ選べ。
本品約0.4gを精密に量り、水に溶かし、正確に200 mLとする。この液20 mLを正確に量り、水 40 mL 及び 8 mol/L 「ア」2mLを加え、更にNN指示薬0.1gを加えた後、直ちにイ0.02 mol/L エチレンジアミン四酢酸二水素二ナトリウム液で滴定する。ただし、滴定の終点は液の赤紫色が青色に変わるときとする。
- 「ア」に入れるべき溶液は、「アンモニア・塩化アンモニウム緩衝液」である。
- 下線部イの溶液は遮光のガラス瓶に保存する。
- 「ウ」に入れるべき数値は、2.220である。
- Ca2+とエチレンジアミン四酢酸との反応で生じたキレートの錯生成定数は、Ca2+とNN指示薬との反応で生じたキレートの錯生成定数より大きい。
- 本定量法では、試料溶液中に Mg2+ が共存していても、塩化カルシウム水和物を定量することができる。








コメント