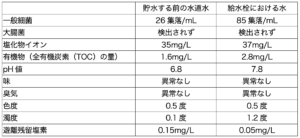
60歳女性。10年前に2型糖尿病の診断を受けた後、インスリン補充療法による薬物治療を行っている。薬剤師が面談したところ、患者は毎月の支払費用を負担に感じていたとのことであった。そこで、医師にインスリン グラルギンのバイオ後続品に切り替えることで医療費軽減になることを提案し、医師はバイオ後続品への切り替えを認めた。薬剤師は、このバイオ後続品の添付文書等を確認した上で、患者に説明することになった。なお、併用薬はない。
問306(実務)
このバイオ後続品に切り替えるにあたり薬剤師が説明する内容として正しいのはどれか。2つ選べ。
- 今まで使っていたお薬と比べて効果に変わりないことが確認されています。
- 今まで使っていたお薬と比べて低血糖などの副作用は同様ですので、切り替えた後も同様に注意して生活してください。
- 今まで使っていたお薬より安定性が悪いので、開封後も冷蔵庫で保管してください。
- 今まで使っていたお薬と主成分と添加剤は全く同じです。
- 今まで使っていたお薬と同じ製造販売業者のものです。
問 307(法規・制度・倫理)
このバイオ後続品は、先行バイオ医薬品の特許期間、再審査期間の終了後に開発されたものである。バイオ医薬品の場合、一般的な化学合成の医薬品とは特性が異なるため、バイオ後続品の製造販売承認申請に必要な資料は、通常の後発医薬品とは異なる。次のうち、後発医薬品の承認申請には不要であるが、バイオ後続品の承認申請に必要になる資料はどれか。1つ選べ。ただし、吸入粉末剤の後発医薬品は例外とする。
- 製造方法に関する資料
- 費用対効果に関する資料
- 生物学的同等性に関する資料
- 臨床試験成績に関する資料
- 添付文書等記載事項に関する資料




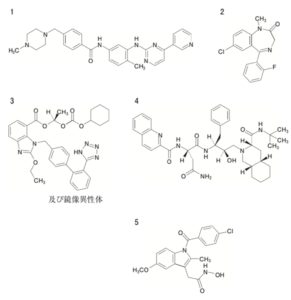
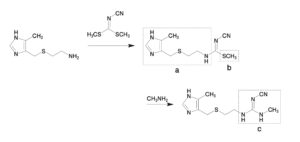
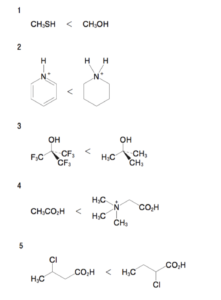
コメント