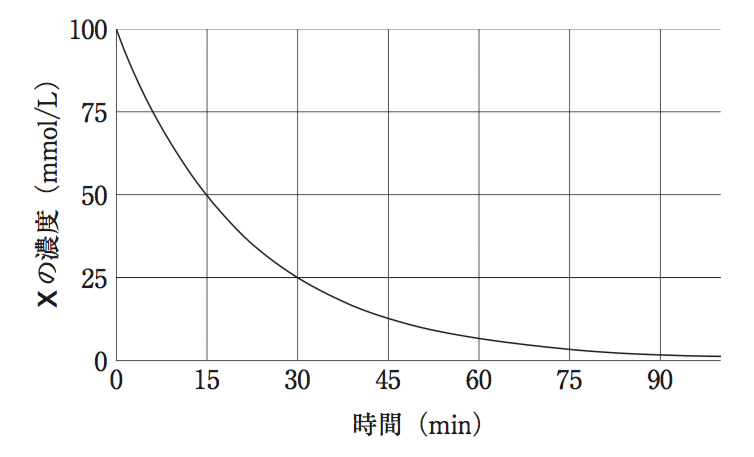
ある分子X(初濃度100mmol/L)が分解して2分子のY(初濃度0mmol/L)が生成する反応
において、下のグラフはXの濃度の時間変化を表す。この反応に関する記述のうち、正しいのはどれか。2つ選べ。
- 横軸の時間10分でのYの濃度は、同じ時間のXの濃度の2倍である。
- この分解反応は、一次反応である。
- この分解反応の速度定数の符号は負である。
- 同じ時間でのXとYの濃度変化曲線の接線の傾きの絶対値は等しい。
- Xの濃度が初濃度の1/2になるまでにかかる時間は、Yの濃度が100mmol/Lから150mmol/Lになるまでにかかる時間と等しい。



コメント