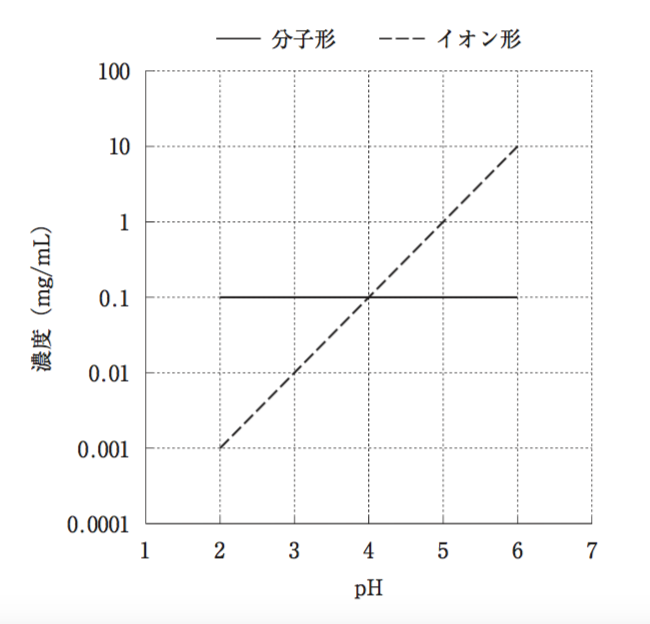
25 °Cにおいて固相が十分に存在する条件下、pHと弱電解質Aの分子形とイオン形の溶解平衡時の濃度の関係を図に表した。以下の記述のうち、正しいのはどれか。2つ選べ。ただし、弱電解質Aの分子形とイオン形の溶解平衡時の濃度比はHenderson–Hasselbalch の式に従い、弱電解質Aの溶解やpH調整に伴う容積変化は無視できるものとする。必要ならば、log2=0.30、log3=0.48、101/2 =3.2を 用いて計算せよ。
- 弱電解質Aは弱酸性化合物である。
- 弱電解質Aの pKa は2.0である。
- 25 ℃において、pH7.0のときの弱電解質Aの溶解度は、pH6.0のときの溶解度の約10倍になると予想される。
- 25 ℃において、pH1.0のときの弱電解質Aの溶解度は、pH2.0のときの溶解度の約1/10倍になると予想される。
- 25℃において、弱電解質A5 mgを水1 mLに分散させたとき、pH5.5以上になると全量が溶解すると予想される。







コメント